| Oxidation |
Abgabe von Elektronen - Merken: Oxidation ist Erhöhung der Oxidationszahl. |
| Reduktion |
Aufnahme von Elektronen - Merken: Reduktion ist Erniedrigung der Oxidationszahl. |
Zur Vermeidung von Missverständnissen werden wir ab jetzt die Oxidationszahlen mit römischen Ziffern darstellen.
Immer geltende Regeln:
| 1. |
Die Oxidationszahlen aller Elemente sind 0. |
| 2. |
In einer Verbindung ist die Summe aller Oxidationszahlen gleich Null. |
| 3. |
Bei einatomigen Ionen entspricht die Oxidationszahl der Ionenladung. |
| 4. |
Bei mehratomigen Ionen ist die Summe der Oxidationszahlen gleich der Ionenladung. |
Häufig geltende Faust-Regeln (FR):
| 5. |
Die Oxidationszahlen sind häufig identisch mit den bevorzugten Ladungszahlen.
Berechnung: OZ= Nummer der Hauptgruppe im PSE
oder OZ = Hauptgruppenummer-8.
|
| 6. |
Die Elemente haben in Verbindungen meist die gleichen OZ
| a) |
Alkalimetalle: |
nur +I |
| b) |
Erdalkalimetalle: |
nur +II |
| c) |
J,Br,Cl: |
-I (außer in Verbindungen mit O) |
| d) |
O: |
-II (außer in Peroxiden: -I) |
| e) |
H: |
+I (außer in Hydriden: -I) |
| f) |
F: |
-I |
|
Oxidationszahlen in der Organik
Jede Bindung zu einem Atom mit niedriger Eletronegativität zählt +I.
Jede Bindung zu einem Atom mit höherer Eletronegativität zählt -I.
Jede Bindung zu einem Atom mit gleicher Eletronegativität zählt 0.
Potenzialberechnung mit der Nernst-Gleichung:
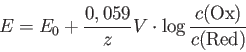
Achtung bei Berechnungen:
Die Konzentration fester Stoffe (z.B. Metall) ist willkürlich = 1 mol/L gesetzt.
Auf dem 'Rechner' muss der zu logarithmierende Wert in Klammern gesetzt werden.
Vereinfachung der Nernst-Gleichung:
Ist der Bruch = 1, so ist der Logarithmus = 0 und der zweite Term fällt weg:
Das Potenzial ist gleich dem Normalpotenzial