Säure/Basen & pH
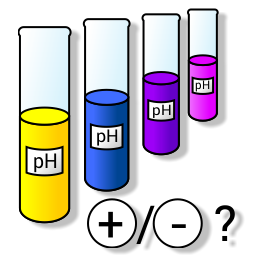 |
Was ist 'Säure/Basen & pH'?Säure/Basen & pH ist eine kleine App, mit der Du Deine Kenntnisse über Säuren, Basen, pH- und pOH-Werte erweitern kannst. |
Was ist 'Säure/Basen & pH'?
Säure/Basen & pH ist eine kleine App, mit der Du Deine Kenntnisse über Säuren, Basen und pOH-Werte erweitern kannst.
Einstellungen
Aufgabenzahl
Ende
Info
Highscore
Start
